Kısa Tarihçesi
19. yüzyıl başlarında elementlerin kimyasal ve fiziksel özelliklerine yönelik hızlı gelişmeler yaşanmıştır. Bu gelişmeler neticesinde ortaya çok sayıda bilgi çıkmıştır. Elementler hakkında elde edilen bu geniş bilgilerin karıştırılmaması için bilim adamları elementleri sınıflandırmak için çalışmalara başlamıştır. Bu sınıflandırma çalışmaları için çok sayıda bilim insanı girişimlerde bulunmuştur. Günümüzde kullanılan periyodik tablonun tarihçesi özellikleri ve modern periyodik tablonun tarihçesi hakkında detayları yazı devamında bulabilirsiniz.
Tarihteki İlk Periyodik Tablo
Mendeleevin ilk periyodik tablosu. İşareti (-) ile gösterilen alanlar, o tarihte henüz bilinmeyen elementleri simgeliyor.Sütunlarda yazılan sembollerse eski stil yazılmış halleridir.
Elementlerin keşifleri ile ilgili ilk çalışmalar 1649 yılında Hennig Brand’ın fosforu bulmasıyla başlamıştır. 1869 yılına kadar 63 element bulunmuştur. Bu elementlerin kendileri ve özellikleri ile ilgili bilgilerin artması, elementlerin özelliklerine göre sınıflandırılması gerekliliğini ortaya koymuştur. Bu alanda çok sayıda araştırma ve çalışma ortaya konmuştur.
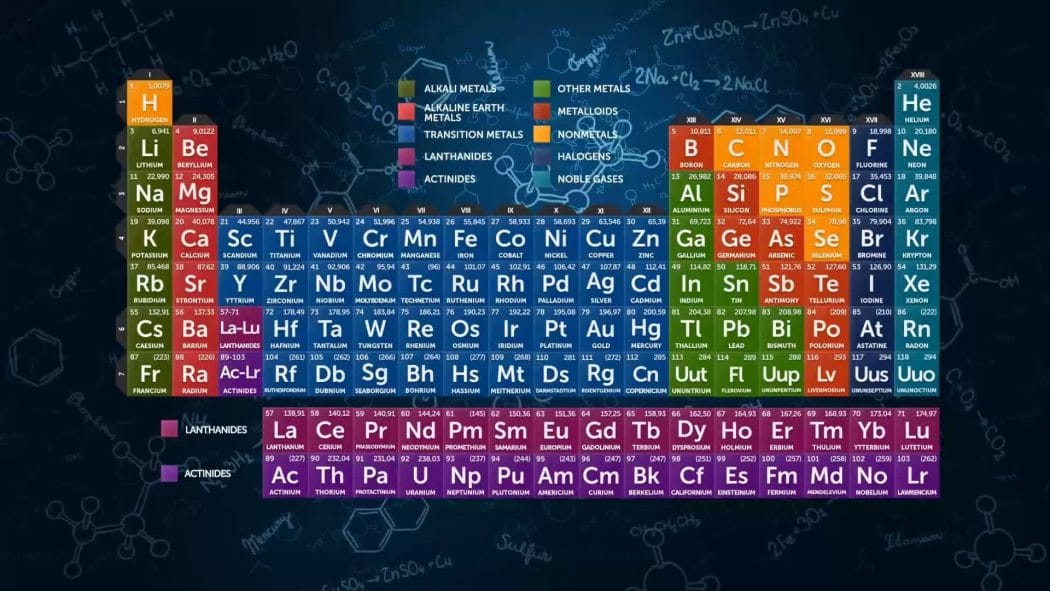
Periyodik Tablonun Genel Özellikleri
- Modern periyodik tabloda elementler artan atom numaralarına göre sıralanmıştır.
- Yatay satırlar, düşey sütunlar halinde düzenlenmiştir.
- Periyodik tabloda 7 periyot bulunur.
- 1. periyotta 2
- 2. ve 3. periyotta 8
- 4. periyotta 18
- 5. periyotta 18
- 6. periyotta 32 element bulunmaktadır.
- 7. periyot daha tamamlanmamıştır.
- 6. ve 7. periyodun 14 er elementi tablonun altına yerleştirilmiştir. Bunlara Lantanitler ve aktinitler denir.
- Gruplar ise A ve B olmak üzere 2 türdür.
- 8 tane A ve 10 tane B grubu bulunmaktadır.
PERİYODİK TABLONUN İSTİSNALARI
1A grubunda hidrojen atomu hariç diğer atomlar metaldir.
– 1. Periyot hariç diğer periyotlar alkali metalle başlar.
– 3A grubundaki Bor(B) ametal özelliği gösterir.
– 7A grubunda ki Flor (F) yaptığı bileşiklerde sadece-1 değerlik alır.
– 8A grubunda ki helyum atomunun değerlik elektron sayısı 2 iken diğer atomların ki 8 dir.
– 7. Periyot hariç diğer periyotlar soygazla biter.
– Helyum hariç diğer soygaz atomlarından önce bir halojen atomu gelir.
– Geçiş metalleri 4.periyottan itibaren başlar.[/minima-alerts]
Bazı Grupların Özel Adları
1A grubu alkali metaller,2A toprak alkali metaller,3A grubu toprak metali,4A grubu karbon grubu,5A grubu azot grubu,6A grubu oksijen grubu,7A grubu halojenler,8A grubu soygazlar veB grupları geçiş metalleri şeklindedir.
Periyodik Tablo Özel Grup İsimleri
1A grubu alkali metaller2A toprak alkali metaller,3A grubu toprak metali,4A grubu karbon grubu,5A grubu azot grubu,6A grubu oksijen grubu,7A grubu halojenler,8A grubu soygazlar veB grupları geçiş metalleri şeklindedir.’
Aynı gruptaki atomların kimyasal özellikleri benzerdir.
Gruplara Kısa İnceleme
1-METALLER
2-AMETALLER
3-YARI METALLER
4-SOYGAZLAR
1-Metaller
♦- Katıdırlar. ( Cıva = Hg hariç )
♦- Yüzeyleri parlaktır.
♦- Isı ve elektriği iyi iletirler.
♦- Tel ve levha haline gelebilirler.
♦- Tek atomludurlar.
♦- Kendi aralarında bileşik yapmazlar.
♦- Kendi aralarında alaşım yaparlar.
♦- Elektron verme özelliğindedirler. ( katyon: +)
♦- Ametallerle iyonik bileşik yaparlar.
♦- Canlıların yapısında çok az bulunur.
♦- Erime-kaynama noktaları yüksektir.
♦- 1A,2A,3A grubunda bulunurlar.
♦- Periyodik tablonun sol tarafında bulunurlar.
♦- Genellikle dayanıklı ağır, parlak maddeler olarak tanımlanır.
♦- Üzerine vurulduğunda çınlama sesi duyulur.
2-Ametaller
♦- Katı, sıvı, gaz halindedirler.
♦- Yüzeyleri mattır.
♦- Isı ve elektriği iyi iletmezler.
♦- Tel ve levha haline gelemezler.
♦- İki ve daha fazla atomludurlar.(molekül yapılı)
♦- Kendi aralarında bileşik yaparlar.
♦- Elektron alma özelliğindedirler. (Anyon: – )
♦- Canlıların yapısında bolca bulunurlar.
♦- Erime-kaynama noktaları düşüktür.
♦- 4A (C atomu),5A,6A,7A grubunda bulunur.
♦- Periyodik tablonun sağ tarafında bulunurlar.
3-Yarı Metaller
Bilinen elementlerin 8 tanesi ( B, Si, Ge, As, At, Sb, Te, Po ) yarı metaldir. Ülkemizde en çok bulunan mineral olan bor, camların yapısına katılan silisyum, elektronik devrelerde kullanılan germanyum en önemli yarı metallerdir.
Yarı metaller fiziksel özellikleri ve görünüşleri yönünden metallere, kimyasal özellikleri Bakımından ametallere benzerler.
♦-Metaller ile ametallerin birleştiği yerde bulunurlar.
♦-Oda koşullarında katı halde bulunurlar.
♦- Parlak veya mat olabilirler.
♦- Elektrik ve ısıyı ametallerden daha iyi, metallerden daha kötü iletirler.
♦- İşlenebilirler. (tel ve levha haline getirilebilirler )
♦- Kırılgan değildirler.
♦- Sıcaklık yükseldiğinde elektrik iletkenlikleri artar.
4-Soygazlar
♦- Doğada gaz halinde bulunurlar.
♦- Kararlı yapıdadırlar.
♦- Bileşik oluşturmazlar.
♦- Tek atomludurlar.
♦- Erime kaynama noktaları düşüktür.
♦- Periyodik tabloda 8A grubunda yer alırlar.
♦- Ametaller grubunda yer alırlar.
Periyodik Tabloda Değişen Özellikler

Bir Periyotta Soldan Sağa Doğru Gidildikçe ;
- Atom no, kütle no, proton sayısı, atom kütlesi, nötron sayısı, elektron sayısı, değerlik elektron sayısı artar.
- Atom çapı ve hacmi küçülür.
- İyonlaşma enerjisi artar.
- Elektron ilgisi ve elektronegatifliği artar. (8A hariç)
- Elementlerin metal özelliği azalır, ametal özelliği artar. (8A hariç)
- Elementlerin oksitlerinin ve hidroksitlerinin baz özelliği azalır, asitlik özellik artar. (8A hariç)
- Elementlerin indirgen özelliği azalır, yükseltgen özelliği artar. (8A hariç)
Bir Grupta Yukarıdan Aşağıya Doğru İnildikçe ;
- Proton sayısı, nötron sayısı, elektron sayısı, çekirdek yükü, Atom no, Kütle no artar.
- Atom çapı ve hacmi büyür.
- Değerlik elektron sayısı değişmez.
- İyonlaşma enerjisi, elektron ilgisi ve elektronegatiflik azalır.
- Elementlerin metal özelliği artar, ametal özelliği azalır.
- Elementlerin, oksitlerin ve hidroksitlerin baz özelliği artar, asit özelliği azalır.
- Elementlerin indirgen özelliği artar, yükseltgen özelliği azalır.
Kaynak:fenokulu.net — egitimpusulasi.net — bikifi.com